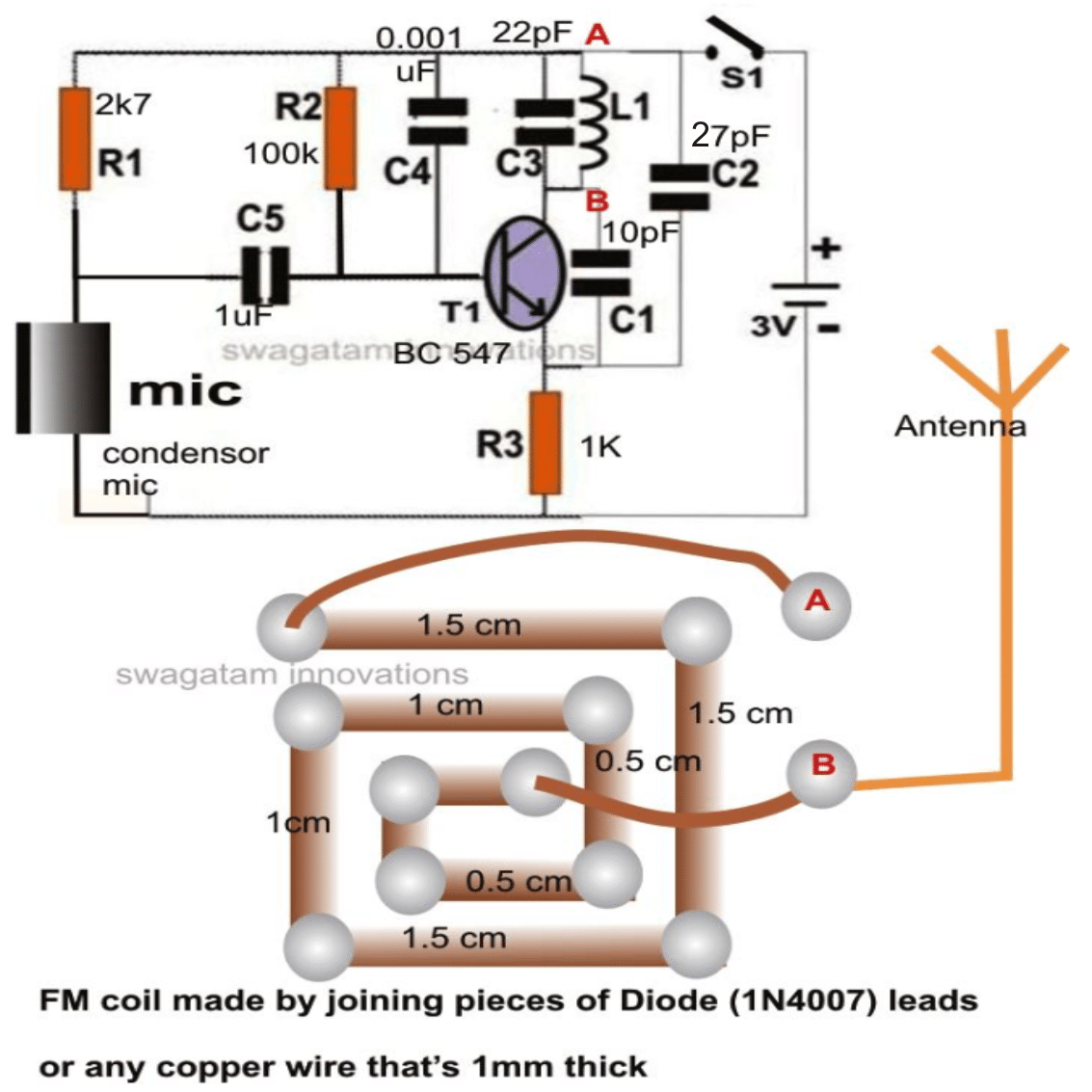
Sausā šūna ir vienkāršākais elektroenerģijas ražošanas veids. Vairāki elementi, apvienojot šūnas, kopā veido akumulatoru. The svina-skābe vai niķeļa-kadmija akumulatoru ir uzlabota sauso šūnu versija. Šo kameru pirmo reizi izgudroja franču inženieris Žoržs Leklančs 1866. gadā. Viņa izgudrojums tika nosaukts pēc viņa vārda kā Leklanšas akumulators. Bet tajā laikā tas bija ļoti smags un to varēja viegli salauzt. Sausai kamerai ir tāds pats princips, un tā ir uzlabota Leclanche akumulatora versija, un tai ir dažādi spriegumi un izmēri. Cinka-oglekļa elementa komerciālo formu, kas ir modificēta Leklanšas akumulatora forma, 1881. gadā izgudroja Karls Gassners no Maincas. To ražo lielos daudzumos un izmanto daudzās lietojumprogrammās, piemēram, rotaļlietās, radioaparātos, kalkulatoros utt.
Kas ir sausa šūna?
Sausā šūna ir ierīce, kas ražo elektrību, pamatojoties uz ķīmiskām reakcijām. Kad abi šūnas elektrodi ir savienoti pa slēgtu ceļu, tad šūna liek elektroniem plūst no viena gala uz otru. Elektronu plūsma izraisa strāvas plūsmu slēgtā kontūrā.

Sausie šūnu slāņi
Ar ķīmisko reakciju palīdzību elektroni plūst no viena gala uz otru. Kad divas vai vairākas šūnas, kas savienotas ar pareizu polaritāti, liela potenciāla dēļ plūst vairāk elektronu. Šo kombināciju sauc par akumulatoru. No minimālā sprieguma 1,5 V līdz 100 V sprieguma diapazona iegūšanai var izmantot akumulatoru. Pat akumulatora izejas līdzstrāvas spriegumu var regulēt dažādos līmeņos, izmantojot tādus jaudas elektroniskos pārveidotājus kā smalcinātājs ķēdes.
Šūnas struktūra
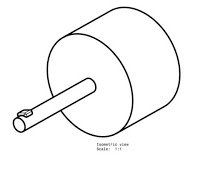
Cinka-oglekļa sausās šūnas struktūra parādīta attēlā. Tas sastāv no anoda spailēm kā cinka vai grafīta stieņa. Ogleklis veido katoda termināli. Var novērot, ka vecākās sauso šūnu versijās cinku izmantoja kā katodu un grafītu - kā anoda termināli. Elementu atlase ir pamatota ar tās ķīmisko konfigurāciju no elementu ārējās orbītas.

Sauso šūnu struktūra
Ja tā vistālākajā orbītā ir vairāk elektronu, tā var darboties kā donors un tādējādi veido katodu. Līdzīgi, ja visattālākajā orbītā ir mazāk elektronu, tā var viegli pieņemt un tādējādi veidot anodu. Starp tiem ievietotais elektrolīts darbojas kā ķīmisko reakciju katalizators. Parasti kā elektrolītu mēs izmantojam amonija hlorīda želeju. Attēlā parādītais elektrolīts ir cinka un hlorīda maisījums. Nātrija hlorīdu lieto arī kā elektrolītu. Ap anoda stieni ir ieskauts mangāna dioksīda un oglekļa maisījums.
Visa konfigurācija tiek ievietota metāla caurulē. Želeju novērš nožūšana, izmantojot piķi šūnas augšdaļā. Apakšā ir ievietota oglekļa paplāksne. Šīs paplāksnes mērķis ir novērst cinka anoda stieņa saskari ar trauku.
To sauc arī par starpliku, kā parādīts diagrammā. Cinka kannu izolācijas nolūkos ieskauj arī papīra izolācija. Lielām baterijām tiek izmantoti arī citi izolācijas materiāli, piemēram, vizla utt. Ella pozitīvais terminālis veidojas augšpusē. Šūnas negatīvais terminālis veidojas pamatnē.
Sausās šūnas apstrāde
Sausa šūna pamatā darbojas ķīmiskās reakcijās. Sakarā ar reakcijām, kas notiek starp elektrolītu un elektrodiem, elektroni plūst no viena elektroda uz otru. Vielas, piemēram, skābes, izšķīst ūdenī, veidojot jonizētas daļiņas. Jonizētā daļiņa ir divu veidu. Pozitīvos jonus sauc par katjoniem, bet negatīvos - par anjoniem. Skābes, kas izšķīdinātas ūdenī, sauc par elektrolītiem.
Iepriekš minētajā diagrammā cinka hlorīds veidojas kā elektrolīts. Līdzīgi amonija hlorīda želeja veidojas arī kā elektrolīts. Elektrolītos iegremdētie metāla stieņi veido elektrodus. Pamatojoties uz metāla stieņu ķīmiskajām īpašībām, mums ir pozitīvs elektrods kā anods un negatīvs elektrods kā katods.
Elektrodi piesaista pretēji lādētos jonus savā pusē. Piemēram, katods piesaista anjonus, bet anods - katjonus. Šajā procesā elektroni plūst no viena virziena uz otru, tādējādi mēs iegūstam lādiņu plūsmu. To sauc strāva .
Ķīmiskās reakcijas
Šūnā notiekošās reakcijas ir parādītas zemāk. Pirmais ir oksidēšanās reakcija.

Šajā laikā cinka katods tiek oksidēts līdz pozitīvi uzlādētiem cinka joniem, atbrīvojot divus jonus. Šos elektronus savāc anods. Tad nāk redukcijas reakcija.

Redukcijas reakcija pie anoda parādīta iepriekš. Šī reakcija rada elektrisko strāvu. Tas atbrīvo oksīda jonus ar magnija oksīdu. Šī reakcija veidojas, ja magnijs tiek apvienots ar elektrolītu.


Divas pārējās reakcijas ir skābes bāzes reakcija un nogulsnēšanās reakcija, kas notiek sausā šūnā. Skābes-bāzes reakcijā NH tiek apvienots ar OH, iegūstot NH3 kopā ar ūdeni. Rezultāti ir NH3 un ūdens bāze.
Atšķirība starp sausu un mitru šūnu
Galvenā atšķirība starp sauso un mitro šūnu ir elektrolīta forma. Kā tika apspriests iepriekš, sausā šūnā elektrolīts, piemēram, amonija hlorīds, ir sauss. Šādas sausas šūnas ir biežāk sastopamas un tiek izmantotas rotaļlietās, radioaparātos utt. Bet mitrā šūnā elektrolīts ir šķidrā stāvoklī.
Tiek izmantoti šķidrie elektrolīti, piemēram, sērskābe, kas ir bīstams kodīgs šķidrums. Šādu šķidrumu rakstura dēļ mitrā šūna ir sprādzienbīstamāka, un ar to jārīkojas uzmanīgi. Vislabākā šādu mitro šūnu priekšrocība ir tā, ka tās var viegli uzlādēt un izmantot daudzām vajadzībām. Šādas baterijas parasti izmanto aviācijā, komunālajos pakalpojumos, enerģijas uzkrāšanā un mobilo tālruņu torņos.
Sauso šūnu funkcijas
Sauso šūnu funkcija, pamatojoties uz ķīmiskām reakcijām starp elektrodu un elektrolītiem. Kad elektrodi tiek ievietoti elektrolītos, tas piesaista pretēji lādētos jonus pret sevi. Tas izraisa lādiņu plūsmu, un līdz ar to rodas strāva.
Priekšrocības
The sausās šūnas priekšrocības iekļaujiet sekojošo.
- Sausajai šūnai ir daudz priekšrocību, piemēram,
- Tas ir maza izmēra.
- Tam var būt dažādi sprieguma līmeņi.
- Tas ir ērts un tam ir daudz lietojumu.
- Tas ir vienīgais līdzstrāvas sprieguma avots.
- To var izmantot kopā ar jaudas elektroniskajām shēmām, lai regulētu izejas spriegumu
- Tas ir uzlādējams.
Trūkumi
The sausās šūnas trūkumi iekļaujiet sekojošo.
- Ar to jārīkojas uzmanīgi
- Tas ir sprādzienbīstams
- Liela akumulatora baterijas ir ļoti smagas
Pieteikumi
The sausās šūnas pielietošana iekļaujiet sekojošo.
- Rotaļlietas
- Aviācija
- Mobilie telefoni
- Radio
- Kalkulators
- Pulksteņi
- Dzirdes aparāti
Līdz ar to mēs esam redzējuši sistēmas darbību, klasifikāciju un pielietojumu sausas šūnas . Interesants ir fakts, ka akumulators darbojas tikai tad, kad elektrodi fiziski saskaras viens ar otru. Starp abiem elektrodiem jābūt vadošai videi. Jautājums ir, vai ūdeni var izmantot kā vadošu vidi starp sausās šūnas elektrodiem? Kas tādā gadījumā notiks, ja šī šūna būs iemērkta ūdenī?