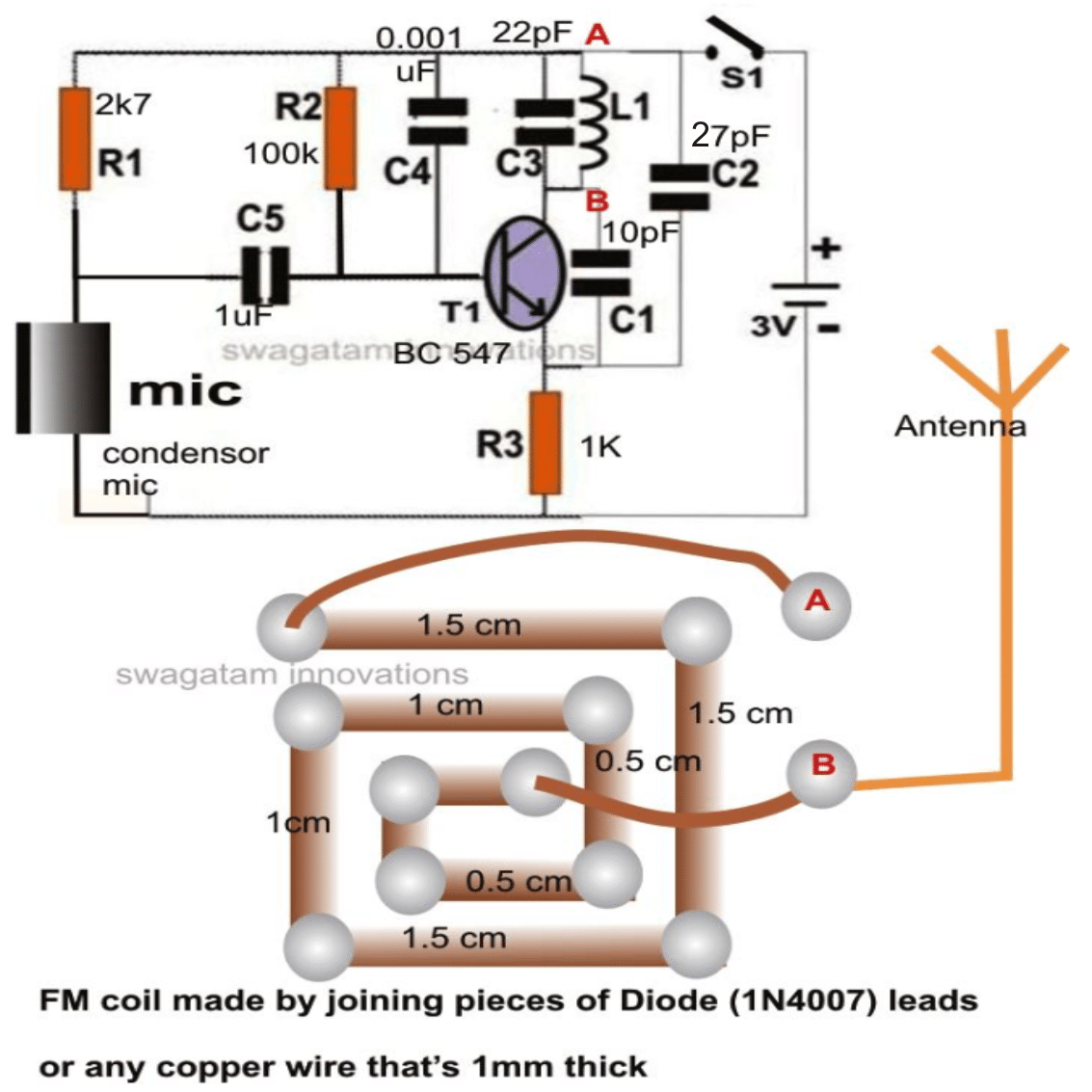
Baterijas ir visizplatītākais enerģijas avots pamata rokas ierīcēm liela mēroga rūpnieciskām vajadzībām. Bateriju var definēt, jo tā ir viena vai vairāku elektroķīmisko šūnu kombinācija, kas spēj pārveidot uzkrāto ķīmisko enerģiju elektriskajā enerģijā.

Akumulatora darbība:
Akumulators ir ierīce, kas sastāv no dažādiem volta elementiem. Katra volta šūna sastāv no divām pusšūnām, kuras virknē savieno vadošs elektrolīts, kas satur anjonus un kaķu jonus. Vienā puselementā ietilpst elektrolīts un elektrods, uz kuru pārvietojas anjoni, t.i., anods vai negatīvais elektrods, otrā puselementā ietilpst elektrolīts un elektrods, uz kuru pārvietojas kaķu joni, t.i., katods vai pozitīvais elektrods.
Redoksa reakcijā, kas darbina akumulatoru, samazināšanās notiek katjonos pie katoda, bet oksidēšanās notiek anjonos pie anoda. Elektrodi nepieskaras viens otram, bet tos elektriski savieno elektrolīts. Pārsvarā pusšūnās ir dažādi elektrolīti. Visas lietas, kas tiek uzskatītas par katru pusšūnu, ir ievietotas traukā, un separators, kas ir porains pret joniem, bet ne lielākā daļa elektrolītu, novērš sajaukšanos.

Baterijas darbība
Katrai pusei šūnas ir elektromotors (Emf), ko nosaka tā spēja vadīt elektrisko strāvu no šūnas iekšpuses uz ārpusi. Šūnas neto emf ir starpība starp tās pusšūnu emf. Tādā veidā, ja elektrodiem ir emf un citiem vārdiem sakot, neto emf ir starpība starp pusreakciju reducēšanas potenciāliem.
Kā uzturēt akumulatoru?
Lai uzturētu akumulatoru labā stāvoklī, ir nepieciešams izlīdzināt akumulatoru. Novecošanas dēļ visas šūnas neuzlādējas līdzīgi, un dažas šūnas uzlādi pieņem ārkārtīgi ātri, bet citas pakāpeniski. Izlīdzināšanu var veikt, nedaudz uzlādējot akumulatoru, lai ļautu pilnībā uzlādēt arī vājākām šūnām. Pilnībā uzlādēta akumulatora spailes spriegums ir 12 V, automobiļa akumulatora spailēs ir 13,8 V, bet 12 voltu cauruļveida akumulatorā - 14,8 V. Automašīnas akumulatoram jābūt stingri nostiprinātam transportlīdzeklī, lai izvairītos no kratīšanas. Invertora akumulators, ja iespējams, jānovieto uz koka dēļa.
2 bateriju veidi
1) Primārās baterijas:
Kā norāda nosaukums, šīs baterijas ir paredzētas vienreizējai lietošanai. Pēc šo akumulatoru lietošanas tos nevar uzlādēt, jo ierīces nav viegli atgriezeniskas un aktīvie materiāli var neatgriezties sākotnējā formā. Akumulatoru ražotāji neļauj uzlādēt primāros elementus.
Daži vienreiz lietojamo bateriju piemēri ir parastās AA, AAA baterijas, kuras mēs izmantojam sienas pulksteņos, televizora tālvadības pultī utt. Cits šo bateriju nosaukums ir vienreizlietojamās baterijas.

Veidi Akumulators
2) Sekundārās baterijas:
Sekundārās baterijas sauc arī par uzlādējamām baterijām. Šīs baterijas var vienlaikus izmantot un uzlādēt. Parasti tos samontē ar aktīviem materiāliem ar aktīvu izlādētā stāvoklī. Uzlādējamās baterijas tiek uzlādētas, izmantojot elektrisko strāvu, kas novērš ķīmiskās reakcijas, kas notiek izlādes laikā. Lādētāji ir ierīces, kas nodrošina nepieciešamo strāvu.
Daži šo uzlādējamo bateriju piemēri ir akumulatori, ko izmanto mobilajos tālruņos, MP3 atskaņotājos utt. Tādas ierīces kā dzirdes aparāti un rokas pulksteņi izmanto miniatūras šūnas, un tādās vietās kā tālruņa centrāles vai datoru datu centri tiek izmantotas lielākas baterijas.

Sekundārās baterijas
Sekundāro (uzlādējamo) bateriju veidi:
SMF, svina skābe, Li un Niks
SMF akumulators:
SMF ir a noslēgta bez apkopes akumulators, kas paredzēts uzticamas, konsekventas un zemas uzturēšanas jaudas nodrošināšanai UPS lietojumprogrammām. Šīs baterijas var pakļaut dziļa cikla lietošanai un minimālai apkopei lauku un enerģijas deficīta apgabalos. Šīs baterijas ir pieejamas no 12 V.
Mūsdienu informatīvajā pasaulē nevar nepamanīt prasību, ka akumulatoru sistēmas ir paredzētas svarīgu kvalificētu datu un informācijas atgūšanai un pamata instrumentu darbināšanai vēlamajam ilgumam. Baterijas ir nepieciešamas tūlītējas enerģijas piegādei. Neuzticami un sliktāki akumulatori var izraisīt datu un iekārtu izslēgšanu, kas uzņēmumiem var izmaksāt ievērojamus finansiālus zaudējumus. Pēc tam UPS segmenti prasa izmantot uzticamu un pārbaudītu akumulatoru sistēmu.

SMF akumulators
Litija (Li) akumulators:
Mēs visi to izmantojam portatīvajās ierīcēs, piemēram, mobilajā telefonā, klēpjdatorā vai elektroinstrumentā. Litija akumulators ir bijis viens no lielākajiem sasniegumiem pārnēsājamā enerģijas jomā pēdējās desmitgades laikā, lietojot litija baterijas, un mēs esam spējuši pāriet no melnbaltās mobilās uz krāsainām mobilajām ierīcēm ar papildu funkcijām, piemēram, GPS, e-pasta brīdinājumiem utt. Šie ir augsti enerģijas blīvuma potenciāla ierīces lielākai jaudai. Un salīdzinoši zemas pašizlādes baterijas. Arī īpašās šūnas var nodrošināt ļoti lielu strāvu tādām lietojumprogrammām kā elektroinstrumenti.

Li akumulators
Niķeļa kadmija (Nicd) akumulators:
Niķeļa kadmija bateriju priekšrocība ir tā, ka tās tiek daudzkārt uzlādētas, un tām ir salīdzinoši nemainīgs potenciāls izlādes laikā, kā arī tām ir lielāka elektriskā un fiziskā izturība. Šajā akumulatorā katodam tiek izmantots niķeļa oksīds, kadmija savienojums anodam un kālija hidroksīda šķīdums kā elektrolīts.

Kad akumulators ir uzlādēts, katoda ķīmiskais sastāvs tiek pārveidots un niķeļa hidroksīds mainās uz NIOOH. Anodā kadmija joni veidojas no kadmija hidroksīda. Kad akumulators ir izlādējies, kadmijs reaģē ar NiOOH, veidojot atpakaļ niķeļa hidroksīdu un kadmija hidroksīdu.
Cd + 2H2O + 2NiOOH -> 2Ni (OH) 2 + Cd (OH) 2
Svina skābes akumulators:
Svina skābes akumulatorus plaši izmanto automašīnās, invertoros, rezerves enerģijas sistēmās utt. Atšķirībā no cauruļveida un bez apkopes akumulatoriem, svina skābes akumulatoriem ir nepieciešama pienācīga aprūpe un apkope, lai pagarinātu to kalpošanas laiku. Svina skābes akumulators sastāv no virknes plātņu, kas tiek iegremdētas sērskābes šķīdumā. Plātnēm ir režģi, uz kuriem piestiprināts aktīvais materiāls. Plātnes ir sadalītas pozitīvās un negatīvās plāksnēs. Pozitīvajās plāksnēs aktīvais materiāls satur tīru svinu, kamēr svina oksīds ir pievienots negatīvajām plāksnēm.

Svina skābes akumulators
Pilnībā uzlādēts akumulators var izlādēt savu strāvu, ja tas ir pievienots kravai. Izvadīšanas procesā sērskābe apvienojas ar aktīvajiem materiāliem uz pozitīvajām un negatīvajām plāksnēm, kā rezultātā veidojas svina sulfāts. Ūdens ir vissvarīgākais solis svina skābes akumulatora uzturēšanā. Ūdens biežums ir atkarīgs no lietošanas, uzlādes metodes un darba temperatūras. Procesa laikā sērskābes ūdeņraža atomi reaģē ar skābekli, veidojot ūdeni.
Tā rezultātā no pozitīvajām plāksnēm atbrīvojas elektroni, kurus pieņem negatīvās plāksnes. Tas noved pie elektriskā potenciāla veidošanās visā akumulatorā. Svina skābes akumulatorā esošais elektrolīts ir sērskābes un ūdens maisījums, kam ir īpašs svars. Īpatnējais svars ir skābes un ūdens maisījuma svars, salīdzinot ar vienādu ūdens tilpumu. Tīrā jonu brīva ūdens īpatnējais svars ir 1.
Svina-skābes akumulatori nodrošina vislabāko enerģijas un enerģijas vērtību uz kilovatstundu, tiem ir visilgākais dzīves cikls un lielas vides priekšrocības, jo tās tiek pārstrādātas ārkārtīgi lielā ātrumā. Neviena cita ķīmija nevar pieskarties infrastruktūrai, kas pastāv svina-skābes akumulatoru savākšanai, transportēšanai un pārstrādei.
Kopā ar šo rakstu tiek apspriests litija jonu akumulators ar tā priekšrocībām un trūkumiem.
Litija jonu akumulatora darbība

Litija jonu akumulatori tagad ir populāri lielākajā daļā elektronisko pārnēsājamo ierīču, piemēram, mobilais tālrunis, klēpjdators, digitālā kamera utt., Pateicoties ilgstošai enerģijas patēriņa efektivitātei. Šīs ir vispopulārākās uzlādējamās baterijas ar tādām priekšrocībām kā vislabākais enerģijas blīvums, nenozīmīgs lādiņa zudums un bez atmiņas efekta. Li-Ion akumulatorā litija joni tiek izmantoti kā lādiņa nesēji, kas izlādes laikā pāriet no negatīvā elektroda uz pozitīvo un uzlādes laikā atpakaļ. Lādēšanas laikā no lādētāja ārējā strāva tiek izmantots pārspriegums nekā akumulatorā. Tas liek strāvai pāriet pretējā virzienā no pozitīvā uz negatīvo elektrodu, kur litija joni iekļaujas porainā elektroda materiālā, izmantojot procesu, ko sauc par Interkalāciju. Litijoni iziet cauri bezūdens elektrolītam un separatora diafragmai. Elektrodu materiāls ir interkalēts litija savienojums.
Li-Ion akumulatora negatīvo elektrodu veido ogleklis, un pozitīvais elektrods ir metāla oksīds. Visbiežāk negatīvā elektroda materiāls ir grafīts, savukārt pozitīvajā elektrodā tas var būt litija kobalta oksīds, litija jonu fosfāts vai litija mangāna oksīds. Kā elektrolītu izmanto litija sāli organiskā šķīdinātājā. Elektrolīts parasti ir organisko karbonātu, piemēram, etilēnkarbonāta vai dietilkarbonāta, maisījums, kas satur litija jonus. Elektrolītā tiek izmantoti anjonu sāļi, piemēram, litija heksa fluorfosfāts, litija heksa fluora arsenāta monohidrāts, litijs uz hlorātu, litija heksa fluora borāts utt. Atkarībā no izmantotā sāls akumulatora spriegums, jauda un darbības laiks mainās. Tīrs litijs enerģiski reaģē ar ūdeni, veidojot litija hidroksīda un ūdeņraža jonus. Tātad izmantotais elektrolīts ir organiskais šķīdinātājs bez ūdens. Elektrodu ķīmiskā loma starp anodu un katodu ir atkarīga no strāvas plūsmas virziena.

Li jonu akumulatora reakcija
Li-Ion akumulatorā abi elektrodi var pieņemt un atbrīvot litija jonus. Interkalācijas procesā litija joni pārvietojas elektrodā. Reversā procesa, ko sauc par de interkalāciju, laikā litija joni pārvietojas atpakaļ. Izlādes laikā pozitīvie litija joni tiks iegūti no negatīvajiem elektrodiem un ievietoti pozitīvajā elektrodā. Uzlādes procesā notiek litija jonu reversā kustība.
Litija jonu akumulatora priekšrocības:
Litija jonu akumulatori pārspēj NiCd akumulatorus un citas sekundārās baterijas. Dažas no priekšrocībām ir
- Neliels svars salīdzinājumā ar citām līdzīga izmēra baterijām
- Pieejams dažādās formās, ieskaitot plakanu formu
- Augsts atvērtas ķēdes spriegums, kas palielina enerģijas pārnesi pie zemas strāvas
- Atmiņas efekta trūkums.
- Ļoti zems pašizlādes līmenis 5-10% mēnesī. NiCd un NiMh akumulatoros pašizlāde ir aptuveni 30%.
- Videi draudzīgs akumulators bez litija metāla
Bet kopā ar priekšrocībām, tāpat kā citām baterijām, litija jonu akumulatoriem ir arī daži trūkumi.
Litija jonu akumulatora trūkumi:
- Laika gaitā nogulsnes elektrolīta iekšienē kavēs lādiņa plūsmu. Tas palielina akumulatora iekšējo pretestību, un pakāpeniski samazinās šūnas spēja piegādāt strāvu.
- Augsta uzlāde un augsta temperatūra var izraisīt jaudas zudumu
- Pārkarsējot, litija jonu akumulators var termiski aizbēgt un šūnas plīst.
- Dziļa izlāde var īssavienot litija jonu akumulatoru. Tāpēc, lai to novērstu, dažos modeļos ir iekšēja izslēgšanas shēma, kas izslēdz akumulatoru, ja tā spriegums pārsniedz drošo līmeni no 3 līdz 4,2 voltiem. Šajā gadījumā, ja akumulators ilgstoši netiek izmantots, iekšējā shēma patērēs enerģiju un iztukšos akumulatoru zem tā izslēgšanas sprieguma. Tātad, lai uzlādētu šādas baterijas, parastie lādētāji nav noderīgi.